いずれの技術分野の特許であっても,どの国で有効化するかを決定する上で重要な基準は,特許発明の実施に際し,どの国に最大の市場がある可能性が高いかということである。
医薬発明の場合,治療する医学的適応症に応じて国の総人口だけでなく年齢分布,ライフスタイルおよびその他の要因にも依存する潜在的な患者人口を評価することが必要である。関連する別の基準は,各国における平均医療費支出である可能性がある。
そこで,医薬発明特許の有効化に影響を与えると考えられる人口,経済およびコスト,ならびにその他の要因について,以下に説明および検討する。
4.1 人口要因および経済要因
医薬品分野の特許のうち,臨床分野のリード化合物を包含する可能性のある特許の場合,全締約国で有効化する戦略を採る。しかし,より低価値の特許の場合,それほど意欲的でない戦略が適切なことがある。
一部の国では有効化するが他の国では有効化しないという考えは,「スイスチーズ」アプローチと呼ばれることもある。目的は,特許の全体的な有効性を大幅に低下させることなくコストを削減することである。
通常は医薬品の場合のように,潜在的に競合する可能性のある製品が規制当局の承認を得るために高コストな試験を必要とする場合,競合他社は,十分な国(「チーズ」)において主な関連市場のすべてが特許の有効化によって保護されていれば,一部の「穴」が保護されずに残されていても,高コストな試験を行うこと(すなわち,そもそも市場に入ること)を思いとどまることがある。
例えば,一人あたりの医療費支出が2,000米ドルより大きなEPC締結国の合計人口はおよそ4億300万人である(表2参照)。この市場の80%を5ヶ国(ドイツ,フランス,英国,スペインおよびイタリア)で有効化された特許のみでカバーすることが可能である。これらの国よりは市場規模が小さいいくつかの国(例えばアイルランド,ベルギー,スイス)は,ごくわずかな追加費用で有効化することができる。これらの国とオランダを追加すれば,市場全体の包含率は90%をはるかに超えることになる。
表2 欧州特許条約締約国の人口および医療費
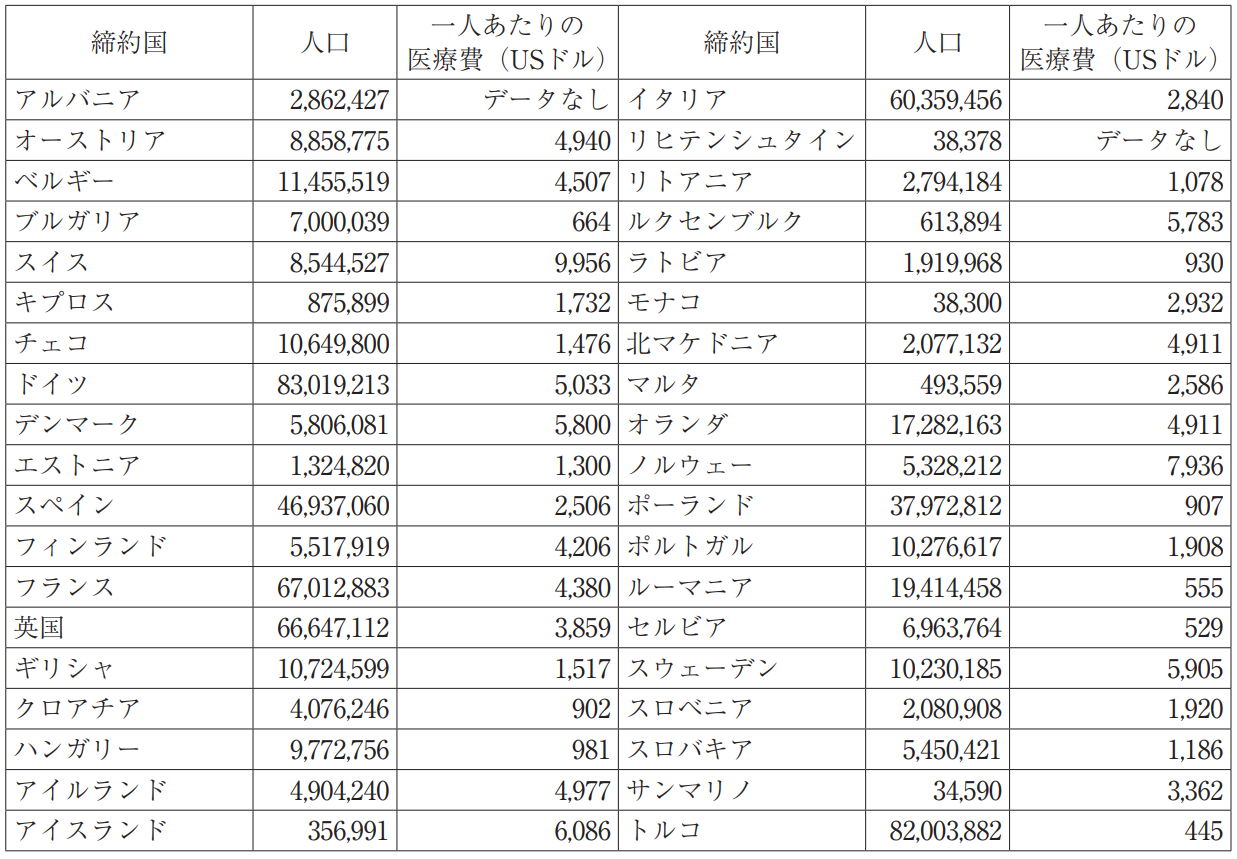
残りの国において競合他社(例えばジェネリック医薬品メーカー)が競合製品を上市することは,経済的でないだろう。残り10%を保護するには,次節で説明するとおり有効化のためにクレームや明細書の翻訳が必要な場合があり,有効化の全体的なコストが大幅に増加する。
この種の戦略では,EPC締約国以外の主要な市場の保護も念頭において,グローバルに見て試験のコストに見合うことを確認する必要がある。
4.2 相対的なコスト
有効化には,時に高額な費用が必要となる。必然的に,資金が潤沢でない出願人にとって,有効化に必要なコストは,特許を有効化する範囲と場所を決定する主要な要因である。各締約国における有効化にかかるコストは,翻訳の要否,また,各国特許庁が要求する手続および手数料によって異なる。
ロンドン協定は,複数の締約国における有効化の手間と費用を大幅に削減した。この協定の調印国は,有効化におけるすべてまたはほとんどの翻訳の要件を撤廃することに同意した。一部のロンドン協定国にとって,有効化は,基本的に自動的であり,正式な手順や翻訳はまったく必要ない。他のロンドン協定国は,クレームのみの翻訳を要求する場合がある。
他方,非ロンドン協定国における有効化は,はるかに面倒になることがあり,クレームのみならず明細書をその国の公用語に翻訳する必要があり,これによりコストが大幅に増加する。
大まかな比較のために,頁で英語10,000ワード,20クレームおよび10図面を含む欧州特許の有効化に必要なコストの概算について,架空の見積を作成した。この見積に基づいて,国別の有効化コストを4つのグループに分けたものを表3に示す。なお,この見積は,大まかな比較のために作成されたものであり,読者はこの見積から実案件のコストを予想すべきではない。
表3 有効化にかかるコスト
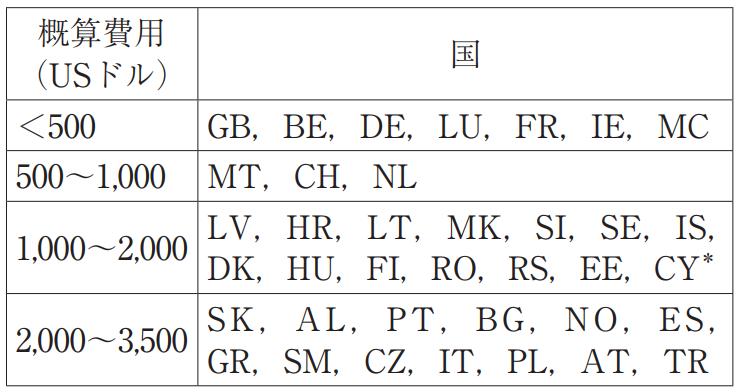
*キプロスはギリシャ語の翻訳文の提出も可能であることから,ギリシャも有効化すると仮定
特定の締約国に有効化するためのコストだけでなく長期的なコスト(維持コスト)も考慮する必要がある。すべてのEPC締約国において,特許を有効に維持するために有効化の後に年次更新手数料を支払う必要があり,これらの手数料の額は様々である。しかし,維持コストの変動は特許の存続期間の終わりに向かってより大きくなる傾向があるため,重要ではあるものの,有効化の決定に際し有効化そのもののコストほどの大きな要因ではない。
4.3 実施およびその他の考慮事項
本稿執筆の時点では,出願時の束から発生した各特許権に対し,各有効化国の国内裁判所において個別に訴訟を行わなければならない。したがって,限られた数の国のみにおいて有効化することを選択する場合,実施の容易さおよび可能性が要因となることがある。現実的に実施が難しすぎる,遅すぎる,費用がかかりすぎる,または不確実すぎる国において特許を取得することにほとんど意味はないといえる。しかし,欧州特許に関する侵害および無効訴訟を審理する中央機関化された裁判所(統一特許裁判所)の設立が現実になる日が近づいており,同裁判所での決定は統一特許裁判所制度に参加するすべての欧州連合(EU)国に拘束力を持つことになる。
欧州での特許訴訟において,最も重要な管轄区域は,ドイツおよび英国であり,フランスおよびオランダがこれに続く。これらの国における裁判所制度の利用は,経験ある特許裁判官の下で手続が行われることを保証し,これらの裁判所が毎年多数の特許事件を受理する。一部の裁判所は,特許権者に有利な制度を設けている。例えば,オランダの裁判所は,過去に自らが国境を越えた差止命令を認めることを厭わないことを示しており,フランスにおいては,侵害訴訟を始めるためにセジーコントルファソン(saisie-contrefaçon)と呼ばれる予備手続が一般的に使用され,侵害者と思われる者に圧力をかけるための強力なツールとなっている。
多くの国が価格管理を行う医薬品については,並行輸入(商品の自由移動)のリスクが有効化戦略にどの程度影響を及ぼすかについてもよく質問を受ける。驚くかもしれないが,「それほど大きくはない」というのが答えである。欧州司法裁判所(CJEU)の消尽の原理の下では,権利保有者によってまたは権利保有者の同意によってある製品が欧州経済領域(EEA)において上市されると,特許が保有されている場所に関わりなくその製品をEEA内の他の国に輸入することができる。一方,EEA諸国への第三者(例えばジェネリック)製品の輸入は,特許が保有されていない別のEEAの諸国でそれが製造されたものであっても,その国における関連特許によって防止することができる。







